医薬部外品 とは、「医薬品」に当たらない「部外」品を指します。身体の外に使う薬という意味ではなく、医薬品に準ずるものとして取り扱いに十分な注意が必要です。具体的には、人体に対する作用が緩和された薬品等で、機械器具等でないものを指します。したがって、医薬品、化粧品とも類似した許可の制度になります。
基本となる「医薬部外品製造販売業許可」及び「医薬部外品製造業許可」については、許可を受ける事務所又は製造所の所在地の都道府県知事が申請を取り扱います。許可の場合には5年ごとに更新が必要です。
一つの許可でも内部で区分が分かれておりますが、手続きが法律や手続きの専門家である行政書士の代行も可能ですので、複雑な書類等も多い医療系の申請手続きを行政書士にご依頼ください。

医薬部外品 の製造販売・製造・輸入について
医薬部外品を国内で製造し、出荷するには医薬部外品製造販売業許可、医薬部外品製造業許可の二つが必要となります。
国内での 医薬部外品 製造販売・製造
医薬部外品製造販売業者は、①医薬部外品製造業許可を受けた場所で製品を製造させて、②品質等を確認の上、③市場への出荷判定を行い、市場に出荷することになっています。これを「製造販売」と言いますので、医薬部外品製造販売業許可は出荷責任を負う者が取得する必要がありますが、製造販売業許可のみでは製品の製造を行うことはできません。
”製造”業者 ⇒ ”製造販売”業者⇒ 販売業者(小売り)
つまり、製造は製品のみならずパッケージやラベルも含めたすべての行程を含み、自身の社名等を入れて小売店頭の販売業者に渡します。化粧品では、販売業者(小売り等)は許可不要であり、許可が必要な医薬品とは異なります。
医薬部外品 輸入販売
医薬部外品を輸入して販売する場合であっても、医薬部外品製造販売業許可、海外の製造所については外国製造業者認定が、国内で保管する場所については医薬部外品製造業許可(包装等区分)が必要となります。
「医薬部外品製造販売業許可」及び「医薬部外品製造業許可」については許可を受ける事務所又は製造所の所在地の都道府県知事が取り扱います。海外での製造に関して、「医薬部外品外国製造業者認定」については厚生労働大臣が取り扱います。
製品の承認
さらに、品目ごとに「医薬部外品製造販売承認」を取得することも、医薬部外品の製造販売を行うために必要となります。品目ごとの承認については厚生労働大臣が行う場合と、都道府県知事が承認を行う場合とがあります。
医薬部外品 についての定義
医薬部外品はその用途に合わせ、次のように3区分されています。薬機法で「医薬部外品」とは、次に掲げる物であって人体に対する作用が緩和なものをいいます。(薬機法第2条第2項)
この区分によって許可の内容が変わることはありませんが、製品の承認時には必要となります。
薬機法第2条第2項第一号
次のイからハまでに掲げる目的のために使用される物であって機械器具等でないもの
イ 吐きけその他の不快感又は口臭若しくは体臭の防止
ロ あせも、ただれ等の防止
ハ 脱毛の防止、育毛又は除毛
薬機法第2条第2項第二号
人又は動物の保健のためにするねずみ、はえ、蚊、のみその他これらに類する生物の防除の目的のために使用される物であつて機械器具等でないもの
薬機法第2条第2項第三号
前項第二号又は第三号に規定する目的のために使用される物のうち、厚生労働大臣が指定するもの
(昭和36年厚生省告示第14号)
| 一 | 胃の不快感を改善することが目的とされている物 |
| 二 | いびき防止薬 |
| 三 | 衛生上の用に供されることが目的とされている綿類 |
| 四 | カルシウムを主たる有効成分とする保健薬 |
| 五 | 含嗽薬 |
| 六 | 健胃薬 |
| 七 | 口腔咽喉薬 |
| 八 | コンタクトレンズ装着薬 |
| 九 | 殺菌消毒薬 |
| 十 | しもやけ・あかぎれ用薬 |
| 十一 | 瀉下薬 |
| 十二 | 消化薬 |
| 十三 | 滋養強壮、虚弱体質の改善及び栄養補給が目的とされている物 |
| 十四 | 生薬を主たる有効成分とする保健薬 |
| 十五 | すり傷、切り傷、さし傷、かき傷、靴ずれ、創傷面等の消毒又は保護に使用されることが目的とされている物 |
| 十六 | 整腸薬 |
| 十七 | 染毛剤 |
| 十八 | ソフトコンタクトレンズ用消毒剤 |
| 十九 | 肉体疲労時、中高年期等のビタミン又はカルシウムの補給が目的とされている物 |
| 二十 | のどの不快感を改善することが目的とされている物 |
| 二十一 | パーマネント・ウェーブ用剤 |
| 二十二 | 鼻づまり改善薬 |
| 二十三 | ビタミンを含有する保健薬 |
| 二十四 | ひび、あかぎれ、あせも、ただれ、うおのめ、たこ、手足のあれ、かさつき等を改善することが目的とされている物 |
| 二十五 | にきび、肌荒れ、かぶれ、しもやけ等の防止又は皮膚若しくは口腔の殺菌消毒に使用されることも併せて目的とされている物 |
| 二十六 | 浴用剤 |
| 二十七 | 第六号、第十二号又は第十六号に掲げる物のうち、いずれか二以上に該当するもの |
上記リストに掲載されているからといって、必ずしも医薬部外品に当たるとは限りません。例えば、整腸薬など作用の強いものは「医薬品」に分類されることもあるなど、用途だけでなく効果が緩慢かどうかにも左右されます。
医薬部外品 で必要な許可の見極め
医薬部外品は、医薬品・化粧品・医療機器と同様に「薬機法」にて規制されているため、国内製造又は輸入した医薬部外品を販売・授与するためには、通常、次の許可が必要となります。また、許可のほかに、原則取り扱う品目ごとに承認が必要です。
以下に4つの事例を掲載します。 医薬部外品を国内または海外で製造し、出荷するのに必要な薬部外品製造販売業許可、医薬部外品製造業許可をご覧ください。
A 国内製造の 医薬部外品 を自社製品として、自ら市場に出荷する場合
他社製品を購入し、自社のラベルを付けた製品を出荷する場合です。
- 医薬部外品を国内の市場へ出荷するためには、“医薬部外品製造販売業許可”を取得
- 出荷する品目が“医薬部外品製造販売承認”を受けている
製造販売業者は製品の市場における責任者となり、医薬部外品製造販売承認に基づき製造された製品の品質や安全性を確保する業務を行います。
また、“医薬部外品製造販売業許可”では製造行為を行うことができないので、実際の製造については、製造販売承認に則った製造を行うため、必要な許可区分を持つ医薬部外品製造業者へ製造委託を行うことになります。
なお、製造販売業者が併せて製造業許可を取得することは可能です。
B 医薬部外品 を市場に自ら出荷せずに、製造(包装・表示・保管を含む)を行う場合
中身の製造をしなくても、製造業の許可が必要です。保管だけでも該当する場合があります。
- 医薬部外品製造販売業者から委託を受け、医薬部外品製造販売承認に則った製造を行う
- 製造所ごと及び製造区分ごとの“医薬部外品製造業許可”を取得する必要
製造販売業としての市場への出荷判定が済んでいない製品は、製造業許可をうけた製造所に保管する必要があります。
医薬部外品の許可の区分は次のとおりです。
- 無菌区分(1号区分):無菌医薬部外品の製造工程の全部又は一部を行える
- 一般区分(2号区分):無菌医薬部外品以外の製造工程の全部又は一部を行える
- 包装等区分(3号区分):医薬部外品の製造工程のうち包装、表示、保管のみを行える。
なお、同一製造所で複数の製造区分を取得することは可能です。
C 輸入した 医薬部外品 を、自社製品として自ら市場に出荷する場合
海外における製造については医薬部外品外国製造業者認定をうけた製造業者へ製造委託を行うことになります。
- 医薬部外品を国内の市場へ出荷するためには、“医薬部外品製造販売業許可”を取得
- 出荷する品目が“医薬部外品製造販売承認”を受けている必要
製造販売業者は製品の市場における責任者となり、医薬部外品製造販売承認に基づき製造された製品の品質や安全性を確保する業務を行います。
また、“医薬部外品製造販売業許可”では製造行為を行うことができないので、実際の製造については、製造販売承認に則った製造を行うため、必要な許可区分を持つ医薬部外品製造業者へ製造委託を行うことになります。
その際、国内の製造については医薬部外品製造業許可を取得した医薬部外品製造業者へ、海外における製造については医薬部外品外国製造業者認定をうけた製造業者へ製造委託を行うことになります。
医薬部外品外国製造業者認定については、独立行政法人医薬品医療機器総合機構にて取り扱います。
なお、製造販売業者が併せて製造業許可を取得することは可能です。
D 既に市場に出荷されている 医薬部外品 を、販売・授与する場合
国内の医薬部外品製造販売業者により市場へ出荷された製品を流通させる際は、販売・授与に係わる許可は必要ありません。ただし、以下の行為はできません。
- 国内の製造販売業者が出荷していない製品を流通させる行為
- 製造販売業者が出荷した製品の製造行為(ラベルを変える等を含む)
既に市場に出荷されている医薬部外品を保管する場合には、医薬部外品製造販売業者により市場へ出荷された製品を保管する際は、保管の許可は必要ありません。
ただし、製造販売業としての市場への出荷判定が済んでいない製品は、製造業許可をうけた製造所に保管する必要があります。
医薬部外品 製造販売業 の要件
医薬部外品「製造販売」業の許可を受けるためには、以下の4条件を満たさなければいけません。
- 申請者(法人にあっては薬事に関する業務に責任を有する役員(以下、「責任役員」))が欠格条項に該当しないこと
- 品質管理の方法が厚生労働省令で定める基準に適合すること(GQP省令)、
- 製造販売後安全管理の方法が厚生労働省令で定める基準に適合すること(GVP省令)、
- 総括製造販売責任者を設置すること
申請者(法人の場合は責任役員)の欠格条項
イ 第75条第1項の規定により許可を取り消され、取消しの日から3年を経過していない者
ロ 第75条の2第1項の規定により登録を取り消され、取り消しの日から3年を経過していない者
ハ 禁錮以上の刑に処せられ、その執行を終わり、又は執行を受けることがなくなつた後、3年を経過していない者
ニ イからハまでにに該当する者を除くほか、この法律、麻薬及び向精神薬取締法(昭和28年法律第14号)、毒物及び劇物取締法(昭和25年法律第303号)その他薬事に関する法令又はこれに基づく処分に違反し、その違反行為があつた日から2年を経過していない者
ホ 麻薬、大麻、あへん若しくは覚醒剤の中毒者
ヘ 心身の障害により薬局開設者(製造販売業者・製造業者)の業務を適正に行うことができない者として厚生労働省令で定めるもの
ト 薬局開設者(製造販売業者・製造業者)の業務を適切に行うことができる知識及び経験を有すると認められない者
総括製造販売責任者の設置
医薬部外品の製造販売業者は、厚生労働省令で定めるところにより、医薬部外品の品質管理及び製造販売後安全管理を行わせるために、医薬部外品の製造販売業者にあっては厚生労働省令で定める基準に該当する者を、置かなければなりません。
品質管理部門に「品質管理責任者」を、安全管理部門に「安全管理責任者」を配置し、これらの業務を統括するものとして「総括製造販売責任者」を置く必要があります。
総括製造販売責任者の基準は以下の通りです。
一 薬剤師
二 旧大学令(大正七年勅令第三百八十八号)に基づく大学、旧専門学校令(明治三十六年勅令第六十一号)に基づく専門学校又は学校教育法(昭和二十二年法律第二十六号)に基づく大学若しくは高等専門学校(以下「大学等」という。)で、薬学又は化学に関する専門の課程を修了した者
三 旧中等学校令(昭和十八年勅令第三十六号)に基づく中等学校(以下「旧制中学」という。)若しくは学校教育法に基づく高等学校(以下「高校」という。)又はこれと同等以上の学校で、薬学又は化学に関する専門の課程を修了した後、医薬品又は医薬部外品の品質管理又は製造販売後安全管理に関する業務に三年以上従事した者
四 厚生労働大臣が前三号に掲げる者と同等以上の知識経験を有すると認めた者
厚生労働省令で定める基準
厚生労働省令で定める基準は、自社の製造工場や委託先製造販売会社がきちんとした製造管理・品質管理を行っているかをチェックするためになります。
品質管理の方法(GQP省令)に適合
- 製造販売業者は、製造販売する製品について、適正な品質を確保するため、品質管理を行わなくてはなりません。
- 医薬部外品の品質管理にあたっては、GQP省令に適合している必要があります。
製造販売後安全管理の方法(GVP省令)に適合
- 製造販売業者は、製造販売している医薬部外品について、安全性の確保を行わねばなりません。
- 医薬部外品の製造販売後安全管理にあたっては、GVP省令に適合している必要があります。
医薬部外品 製造業 の要件
医薬部外品「製造業」許可(もしくは登録)を受けるためには、以下の条件を満たさなければいけません。
- 申請者(法人にあっては薬事に関する業務に責任を有する役員(以下、「責任役員」))が欠格条項に該当しないこと
- その製造所の構造設備が厚生労働省令で定める基準(薬局等構造設備規則)に適合していること(許可の場合)
- 責任技術者の設置
申請者(法人の場合は責任役員)の欠格条項
医薬部外品製造販売業許可と同じ
責任技術者の設置
医薬部外品の製造業者は、厚生労働省令で定めるところにより、医薬部外品の製造を実地に管理させるために、製造所ごとに、責任技術者を置かなければなりません。
責任技術者の資格は、全てを行える一般区分の許可と、保管のみを行う登録で要件の厳しさが異なります。
○製造業許可の場合
一 薬剤師
二 大学等で、薬学又は化学に関する専門の課程を修了した者
三 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する専門の課程を修了した後、医薬品又は医薬部外品の製造に関する業務に三年以上従事した者
四 厚生労働大臣が前三号に掲げる者と同等以上の知識経験を有すると認めた者
○製造業登録の場合
一 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する専門の課程を修了した者
二 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する科目を修得した後、医薬品又は医薬部外品の製造に関する業務に3年以上従事した者
三 厚生労働大臣が前二号に掲げる者と同等以上の知識経験を有すると認めた者
申請する許可区分
医薬部外品製造業の許可は製品を製造するための許可になります。製造工程を検討して、3区分から選択します。
1号区分:無菌化された医薬部外品(無菌医薬部外品)の製造工程の全部又は一部を行うもの(包装、表示、保管のみを行うものを除く)
2号区分:無菌医薬部外品”以外”の医薬部外品の製造工程の全部又は一部を行うもの(包装、表示、保管のみを行うものを除く)
3号区分:1号区分、2号区分の医薬部外品の製造工程のうち、包装、表示、保管のみを行うもの
構造設備
許可を受ける場合、製造所の構造設備が、厚生労働省令で定める基準に適合していることが必要です。
構造設備の内容は、製造業の区分(1号~3号)によって異なっており、薬局等構造設備規則によって定められています。
参照:薬局等構造設備規則(昭和36年2月1日 厚生省令第2号)
製造業登録について
令和3年8月1日の法改正により、医薬品、医薬部外品又は化粧品の製造業について、「許可」に加え、新たに「登録」の制度が設けられました。「登録」は、製造工程のうち「保管のみ」を行う製造所であって、下記①~④の条件のすべてに該当する場合のみ対象となります。
①保管(保管のために必要な検査等を含む。)のみを行う製造所である。
②包装、表示その他の製造行為又は試験検査(当該製造業者の他の試験検査設備又は他の試験検査機関を利用して行う場合を含む。)を行う製造所ではない。
③最終製品(他の製造所に出荷されるものを除く。)の保管を行う製造所ではない。(=市場への出荷を行う製造所ではない。)
④【医薬品の場合】下記通知の2(2)イ~ニに該当する医薬品(生物学的製剤等)を取り扱う製造所ではない。
医薬部外品 の品目ごとの承認
医薬部外品は製造販売業許可のみでは製品の製造販売を行うことはできません。
品目ごとの医薬部外品製造販売承認を取得する必要があります。
製造販売承認審査では、申請者が製造販売を行おうとする製品の成分や効果等について、医薬部外品として妥当かどうか判断されます。例えば、目的としている効果等が医薬部外品の範囲から外れてしまっている場合は承認されません。
よって、医薬部外品製造販売承認を申請する際は、申請品目が医薬部外品の範囲(医薬品医療機器等法第2条第2項)に該当していることや下記の条件を満たすことを申請者自ら確認する必要があります。
医薬品、医薬部外品又は厚生労働大臣の指定する成分を含有する化粧品の製造販売をしようとする者は、品目ごとにその製造販売についての厚生労働大臣の承認を受けなければならない。
薬機法 第14条
”承認”とは、製造販売される製品の品質、有効性及び安全性に関する事項について適当か否か判断され、厚生労働大臣が与えるものです。
ただし、製造販売業許可を保有していないなど、次の場合は承認が与えられません。
1 承認申請者が、製造販売業許可を受けていないとき
2 申請品目の製品を製造する製造所が、製造業許可、認定又は登録を受けていないとき
3 申請に係る医薬部外品の名称、成分、分量、構造、用法、用量、使用方法、効能、効果、性能、副作用その他の品質、有効性及び安全性の審査の結果、その物が次のイからハまでのいずれかに該当するとき
イ 申請に係る医薬部外品がその申請に係る効能、効果又は性能を有すると認められないとき。
ロ 申請に係る医薬部外品がその効能、効果又は性能に比して著しく有害な作用を有することにより、医薬部外品として使用価値がないと認められるとき
ハ イ又はロに掲げる場合のほか、医薬部外品として不適当なものとして厚生労働省令に定める場合に該当するとき。
4 申請に係る医薬部外品が政令で定めるものであるときは、その物の製造所における製造管理又は品質管理の方法が、厚生労働省令で定める基準に適合していると認められないとき。
医薬部外品 共通の申請手続き方法
業者コード登録
許可(登録)申請する事務所又は製造所の所在地や業種が決まりましたら、e-Gov 電子申請サービス(やむをえない場合はファクシミリ)で厚生労働省へ業者コード登録票を提出して、コード番号の付番を受けてください。(注・このコード番号は許可番号ではありません。)
※業者コード登録票の提出先が、都道府県から厚生労働省へ変更されました。
化粧品製造販売業許可 申請
基本は、e-Gov電子申請サービスによる申請となります。
① e-Gov電子申請サービス手続き検索にアクセス
② 「手続き名称から探す」に「業者コード」と入力して検索
③ 「医薬品医療機器等業者コード登録/変更登録」の「申請書入力へ」を選択
④ 必要事項を入力して提出
業者コード登録は、原則として上記e-Gov電子申請サービスからご申請ください。やむをえず電子申請が行えない場合は、申請様式に必要事項を入力し、厚生労働省にファクシミリでご申請します。
化粧品製造販売業許可 申請書作成
FD申請の場合の申請書作成概略は以下の通りです。
「医薬品等電子申請ソフト」は、厚生労働省が無償ソフトウェアとして配布しているものです。使用上の注意事項・Q&A・使用許諾契約書等をご確認のうえご利用ください。
(1)厚生労働省が提供する、「医薬品等電子申請ソフト(FD申請ソフト)」のダウンロード
(2)コンピューターへのインストール
(3)データベースメンテナンス−申請者情報登録(申請者と製造所等の業者コードについてそれぞれ行う。)
(4)申請用データの入力
(5)提出用データ等の作成(正本と申請者控の2部作成の場合)
申請書以外の添付書類は、両業種とも以下にご紹介します。
その他手続き
提出
東京都の場合、申請書提出は窓口のみであり、許可(登録)申請は受付に時間がかかります。
東京都 健康安全研究センター 広域監視部 薬事監視指導課 医薬品審査担当
場所 東京都新宿区百人町3-24-1 本館1階
受付 午前9時から午前11時30分
月曜日から金曜日(土曜日、日曜日、祝日を除く)
なお、申請後に実地調査を行い、許可要件への適合状況等を確認します。
許可(登録)証交付
許可(登録)証の交付については、下記の方法のどちらかを選択できます。
(1)許可(登録)証が出来上がった旨をはがきで通知し、窓口で受け取る。
(2)490円分の切手(簡易書留での送付)を貼った角2型(A4サイズ)に宛先を明記したものを持参し、郵送で受け取る。
事務処理期間
事務処理期間の日数は開庁日で計算しますので、土曜日、日曜日及び祝日は含みません。
以下の場合も事務処理期間の日数として計算しません。
- 不備の訂正等に要した期間
- 申請者の都合により調査が行えなかった期間
- 調査時の指摘事項の改善に要した期間
医薬部外品製造販売業許可(都知事許可)の新規登録なら35日
医薬部外品製造販売業許可更新(都知事許可)の新規登録なら20日
申請料金
窓口において現金で支払いです。
医薬部外品 製造販売業の新規登録なら、GMP省令適用医薬部外品※128,500円、その他 57,400円
※GMP省令適用医薬部外品:医薬品医療機器等法施行令第20条第2項の規定に基づき、製造管理又は品質管理に注意を要するものとして厚生労働大臣が指定する医薬部外品
医薬部外品製造業の新規登録なら、各区分に応じて以下の通りです。
- 無菌 43,700円
- 一般 39,000円
- 包装等 32,800円
- 登録 29,600円
更新期間
- 医薬部外品の製造販売業の許可: 有効期間は5年
- 医薬部外品の製造業の許可: 有効期間は5年
- 医薬部外品の製造業の登録: 有効期間は3年
なお、保管のみを行う製造業に係る登録は3年と許可に比べて短期になっています。
医薬部外品業 許可申請 の添付書類
製造販売業許可申請
1 登記事項証明書:法人の場合 発行後6か月以内のもの
2 薬事に関する業務に責任を有する役員(責任役員)の診断書(※)
3 当該製造販売業の許可証の写し:申請者が現に製造販売業の許可を受けている場合
4 組織図
5 総括製造販売責任者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
6 総括製造販売責任者の資格を証する書類
7 品質管理に係る体制に関する書類
8 製造販売後安全管理に係る体制に関する書類
9 配置図:同一敷地又は建物における、自社と他社使用部分を明示したもの
10 事務所の平面図:製造販売業として使用するフロアの図面
11 保管設備に関する図面:市場への出荷可否判定
12 事務所の案内図:最寄りの駅から事務所までの地図を添付
書類を添付省略できる場合
次の書類については、都知事あてに他の申請書・届出に添付し、提出済みの場合は添付を省略することができます。
①登記事項証明書
②責任役員の診断書
③総括製造販売責任者の資格を証する書類
④総括製造販売責任者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
医薬部外品 製造業の添付書類
1 登記事項証明書:法人の場合 発行後6か月以内のもの
2 責任技術者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
3 責任技術者の資格を証する書類
※医薬品医療機器等法施行令第20条第2項の規定により厚生労働大臣が指定する医薬部外品を取り扱う場合、責任技術者の資格要件は薬剤師のみになります。
4 構造設備の概要一覧表
5 製造設備器具一覧表
6 試験検査器具一覧表
7 他の試験検査機関等の利用概要及び契約書の写し又は利用証明書:他の試験検査機関を利用する場合
8 製造所の配置図:同一敷地内の建物及び建物内の自社と他社の使用部分を示したもの
9 製造所の平面図:保管場所として棚を利用する場合は、その立面図も添付
10 製造しようとする品目の一覧表及び代表一品目の製造工程に関する書類
11 製造所の案内図:最寄りの駅から製造所までの地図を添付
書類を添付省略できる場合
次の書類については、都知事あてに他の申請書・届出に添付し、提出済みの場合は添付を省略することができます。
①登記事項証明書
②責任技術者の資格を証する書類
③責任技術者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
医薬部外品 製造業の登録申請
添付書類
1 登記事項証明書:法人の場合 発行後6か月以内のもの
2 責任技術者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
3 責任技術者の資格を証する書類
4 製造所の場所を明らかにした図面
4-1 製造所の配置図:同一敷地内の建物及び建物内の自社と他社の使用部分を示したもの
4-2 製造所の平面図:登録対象となる範囲が分かるもの
4-3 製造所の案内図:最寄りの駅から製造所までの地図を添付
5 当該製造業の許可(登録)証の写し:申請者が現に製造業の許可又は登録を受けている場合
書類を添付省略できる場合
次の書類については、都知事あてに他の申請書・届出に添付し、提出済みの場合は添付を省略することができます。
①登記事項証明書
②責任技術者の資格を証する書類
③責任技術者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
※内容が提出時と異なっている場合は添付の省略をすることができません。
製造業登録について
令和3年8月1日の法改正により、医薬品、医薬部外品又は化粧品の製造業について、「許可」に加え、新たに「登録」の制度が設けられました。「登録」は、製造工程のうち「保管のみ」を行う製造所であって、下記①~④の条件のすべてに該当する場合のみ対象となります。
①保管(保管のために必要な検査等を含む。)のみを行う製造所である。
②包装、表示その他の製造行為又は試験検査(当該製造業者の他の試験検査設備又は他の試験検査機関を利用して行う場合を含む。)を行う製造所ではない。
③最終製品(他の製造所に出荷されるものを除く。)の保管を行う製造所ではない。
(=市場への出荷を行う製造所ではない。)
④【医薬品の場合】下記通知の2(2)イ~ニに該当する医薬品(生物学的製剤等)を取り扱う製造所ではない。
行政書士 医薬部外品 製造販売業 許可申請 は ご依頼ください
行政書士 医薬部外品 製造販売業 許可申請 は ご依頼ください
以前には薬事法として薬中心でまとめられていましたが、薬機法は正式名称を「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」と言うように、医療機器や安全性なども吸収して大きく管理する仕組みとなりました。医薬品等は人の生命や健康に直接関わるものです。そのため、薬機法では医薬品等の品質不良や虚偽・誇大広告などによる、国民の健康被害を防ぐことを目的に、製造や販売、製品の表示・広告に至るまで厳しい規制が設けられています。
今回の医薬部外品においても、似たような性質を持つ医薬品、医薬部外品、化粧品、医療機器、再生医療等製品の5業種がおおよそ同じ体系で管理されています。その手続きを新規と、業界情報なども取り込んだ更新に分けながらお伝えしたいと思っています。
参考記事: 化粧品製造販売業 許可申請
製造販売業は、製造販売元としての製品の責任を負っていますが、製造業であれば中身に関わること以外でも,包装や梱包、保管等において一般製品と変わらない設備や機能で医薬品業界の高付加価値業務を受託、代行することも可能です。
昨今の薬機法改正などで規制緩和が進み、医薬業界も行政手続きをすればビジネスを拡大していける可能性が広がりました。皆様の起業や事業拡大の要望を実現に向けてお手伝いいたします。

申請ALL. com での 医薬部外品 製造販売業 許可の見積もりの探し方
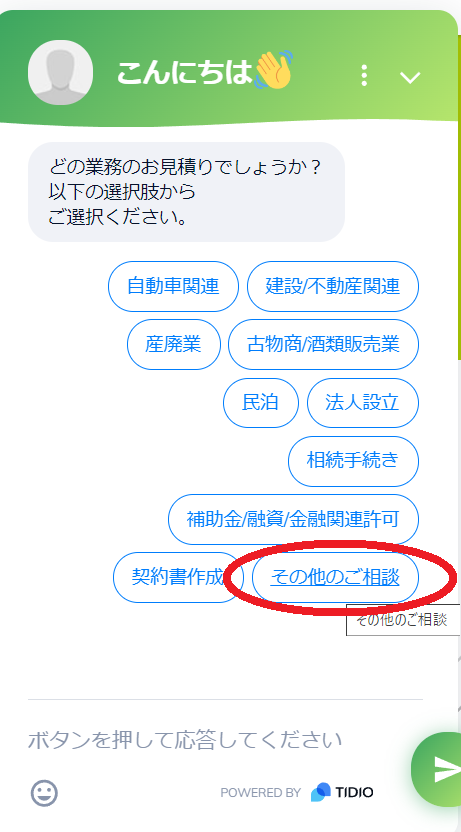
当サイト 申請ALL.com は登録不要で行政書士見積もりを自動でお示しする便利なサイトです。
- 画面右下のチャットボットを開く
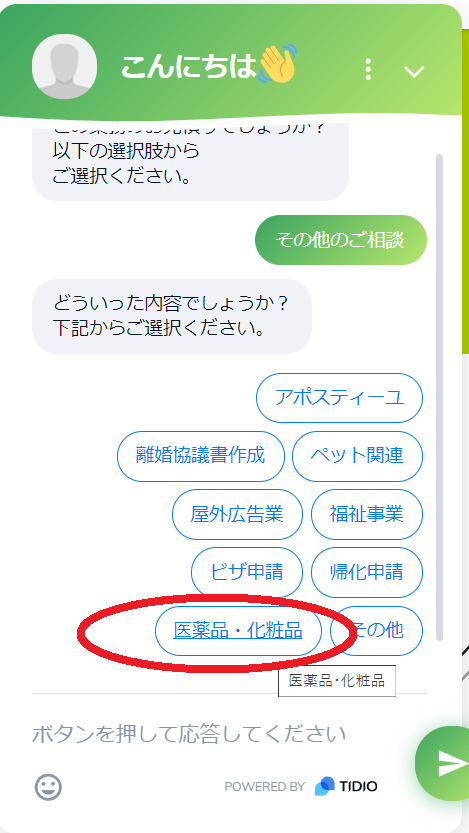
- 業務分類から”その他のご相談”をクリック
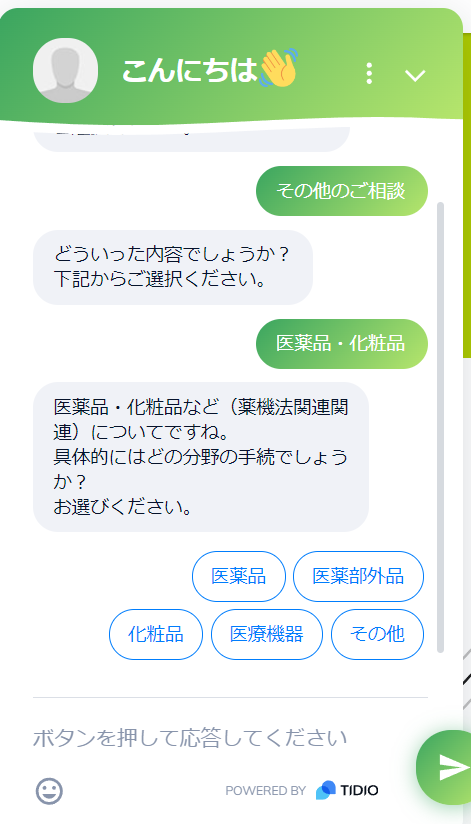
- その他の業務の中から”医薬品・化粧品”をクリック
- 医薬品・化粧品(薬機法関連)の中から対象分野を選択
- その後必要事項を選択し、簡単な質問に答えるだけで、自動でお見積もりが表示されます。
チャットを途中で離脱した場合など、過去の「キャッシュ」が残っていると、スタート画面に戻れない場合があります。
一度、キャッシュを削除して、最初からチャットをスタートしてください。
過去のキャッシュを削除する方法は『申請ALL.comの キャッシュを削除するには?』をご覧ください

開業支援も行政書士にご依頼ください
開業を控えたお客様もご活用ください。
当サイト 申請ALL.com は全ての行政手続にワンストップ対応します。
化粧品製造販売業許可のみならず、会社設立や資金調達、契約書等の書類の作成なども行います。
参考記事:会社設立 ~ 株式会社設立


