再生医療等製品 を市場へ業として出荷(製造販売)することは、薬機法で規制されており、規制当局(厚生労働省及び各都道府県)の許可・承認が必要です。再生医療等製品製造販売業許可 についての手続きを中心に専門家の立場で概略を説明します。他にも医薬品をはじめ薬機法が管轄する製品等の手続きを紹介しています。
iPS細胞などを使った再生医療に関する研究や、病気の仕組みの解明や薬を作る研究は、山中教授のノーベル賞受賞など日本が先端を走ってきた最も熱い業界ですので、日本企業の発展と活躍も期待されます。
成長が期待される分野ながら、未だに業界規模は小さく実用化が急がれています。行政の手続きも確立する過程であり高度に専門的すぎる分野ですが、法律や手続きの専門家である行政書士の代行も可能ですので、複雑な書類等も多い医療系の申請手続きを行政書士にご依頼ください。

再生医療等製品 とは?
再生医療等製品は、2014年施行の薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律、薬事法から題名変更)において新たに定義された品目です。
再生医療等製品は、以下に掲げる製品であって、政令で定めるものをいいます。
人又は動物の細胞に培養等の加工を施したものであって、身体の構造・機能の再建・修復・形成や、疾病の治療・予防、または遺伝子治療を目的として、人の細胞に導入して使用するものになります。
薬機法での再生医療等製品の定義は以下のとおりです。
この法律で「再生医療等製品」とは、次に掲げる物(医薬部外品及び化粧品を除く。)であつて、政令で定めるものをいう。
一 次に掲げる医療又は獣医療に使用されることが目的とされている物のうち、人又は動物の細胞に培養その他の加工を施したもの
イ 人又は動物の身体の構造又は機能の再建、修復又は形成
ロ 人又は動物の疾病の治療又は予防
二 人又は動物の疾病の治療に使用されることが目的とされている物のうち、人又は動物の細胞に導入され、これらの体内で発現する遺伝子を含有させたもの
薬機法 第2条9項
主管する厚生労働省は、再生医療について、「平成26年9月に、世界で初めてiPS細胞を用いた移植手術が行われるなど、着実に成果を上げています。再生医療は、これまで有効な治療法のなかった疾患の治療ができるようになるなど、国民の期待が高い一方、新しい医療であることから、安全性を確保しつつ迅速に提供する必要があります。」と発表しています。
このため、平成26年11月に「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)」と併せて、「再生医療等の安全性の確保等に関する法律」を施行し、再生医療等の安全性の確保に関する手続きや細胞培養加工の外部委託のルール等を定めました。

再生医療とiPS細胞
iPS細胞は、皮膚などの細胞に特定の遺伝子を入れて作ります。受精卵のように体のさまざまな細胞や組織に成長できる「万能性」を持つ。病気やケガで失われた身体機能を回復させる再生医療への活用が期待されています。iPS細胞は、人工多能性幹細胞(induced Pluripotent Stem cell)の略。
京都大学の山中伸弥教授が2006年8月にマウスで初めて作製し、07年11月に人での作製に成功したと発表。山中教授は12年のノーベル生理学・医学賞を受賞し、再生医療への応用を目指す動きが活発化しています。
世界ではこの10年で患者への移植で安全確認が進み、治療効果の検証が本格化する一方で、米国の予算は直近で日本の10倍となり、病気の仕組み解明など幅広い。日本では公的支援の息切れとなっており、研究成果の支援で事業を継続するため「死の谷」を乗り越える戦略が必要とされています。
参照ニュース:iPS研究費、日本は米国の1割 事業化へ「死の谷」課題、日経新聞2023年7月20日
現在、再生医療に用いられているのは、人工的に作りだす「iPS細胞」ではなく、ヒトの身体から採取した「幹細胞」を培養して増やし、利用されています。幹細胞にもたくさんの種類があり、その中でも「間葉系幹細胞」という細胞が再生医療に用いられています。「間葉系幹細胞」はさまざまな臓器・組織に分化できる細胞で、皮膚や脂肪、骨髄などあらゆる場所に存在していますが、採取の難易度、身体への負担、用途、効果などを加味し、どこから採取するか決められます。
再生医療=iPS細胞から実用化に向けて次の段階に移ったと言えるかもしれません。海外では、細胞医療と遺伝子治療の「融合」研究による新たな価値創出が広まり、医療全体でも新しいステージに向かいつつあります。
日本でも令和5年に、ウイルスベクター製品であるルクスターナ(ノバルティスファーマ株式会社製造)を新再生医療等製品として新たに承認しました。 眼の網膜下に投与し、両アレル性RPE65遺伝子変異による遺伝性網膜ジストロフィーの治療に使用されます。(希少疾病用再生医療等製品)
再生医療等製品 の 許可申請 5種類
再生医療製品は、① 製造販売業許可申請、② 製造業許可申請、③ 販売業許可申請、④ 製造販売承認申請、⑤ 外国製造業認定申請の5種類があります。
製造業の審査は、都道府県ではなく、地方厚生局長により許可されるなど、製造販売業とは異なります。再生医療業における技術の特殊性を示しています。
再生医療等製品の製造販売承認申請も、厚生労働省へ申請します。

① 製造販売業許可 申請
再生医療等製品を製造販売するにあたって、製品の市場に対する最終責任、品質保証業務責任、安全管理業務責任を担う能力を持っていることを都道府県へ申請し、許可を受ける必要があります。
② 製造業許可 申請
国内の業者が再生医療等製品の製造を開始するためには厚生労働省へ申請し、許可を受ける必要があります。
地方厚生局長により許可され、申請書は各都道府県の窓口に提出します。
再生医療等製品の製造業の許可の区分は以下の2種類です。第1号の一般区分と、第2号の包装等区分
法第23条の22第2項に規定する厚生労働省令で定める再生医療等製品の製造業の許可の区分は、次のとおりとする。
一 再生医療等製品の製造工程の全部又は一部を行うもの(次号に掲げるものを除く。)
二 再生医療等製品の製造工程のうち包装、表示又は保管のみを行うもの
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則 第137条の8
製造所のいわゆる分置倉庫については、製造行為に付随する業務として、出荷判定待ち製品の保管や出荷判定後の保管出納業務等を行うため、上記包装等の区分の第2号許可を取得する必要があります。
原薬や製剤バルクを輸入して販売する場合は、区分に応じた製造業許可を取得する必要があります。
③ 販売業許可 申請
再生医療等製品を、再生医療等製品の製造販売業者、製造業者若しくは販売業者又は病院、診療所若しくは飼育動物診療施設の開設者などに対し販売等を行うための許可です。
再生医療等製品の販売業者には、生命・健康にかかわる再生医療等製品を取り扱う事業者として、品質等に問題のある再生医療等製品の流通や再生医療等製品の不正流通による保健衛生上の危害が生じないよう、高い倫理観を持ち、薬事に関する法令を遵守して業務を行うことが求められています。
④ 製造販売承認 申請
再生医療等製品そのものに対して性能、安全性等の面で問題がないことを厚生労働省へ申請し、承認を受ける必要があります。厚生労働大臣より承認され、申請書は総合機構の窓口に提出します。
製品ごとに異なるため、ここでは申請手続きの説明をいたしません。
⑤ 外国製造業認定 申請
外国において日本に輸出される再生医療等製品を製造しようとする者を、薬機法における再生医療等製品外国製造業者といいます。 国内製造業者の許可と同様に、認定を受けていることが当該再生医療等製品の製造販売承認の要件となっています。

以下の章で各許可の申請内容を詳細に説明しております。
再生医療等製品 製造販売業 を 許可申請
再生医療等製品の製造販売業の場合には、総括製造販売責任者、品質保証責任者及び、安全管理責任者間の兼務は認められません。医薬業でも種類等に応じて同一人物の兼職を認める場合や、一部可能など対応は分かれます。
標準処理期間、申請手数料
新規申請・更新申請の標準処理期間は35日。なお、書類の不備等が整うまでに費やした日数は含まれません。
許可の有効期間は5年で、5年ごとに更新する必要があります。
申請費用は、新規許可申請・・146,200円、許可更新申請・・135,000円 になります。
添付書類
1 登記事項証明書: 法人の場合、発行後6か月以内のもの
2 薬事に関する業務に責任を有する役員(責任役員)の診断書
法人の場合、薬事に関する業務に責任を有する役員が精神の機能の障害により業務を適正に行うにあたって必要な認知、判断及び意思疎通を行うことができないおそれがある者である場合は、当該責任役員に係る精神の機能の障害に関する医師の診断書
3 当該製造販売業の許可証の写し: 申請者が現に製造販売業の許可を受けている場合
4 総括製造販売責任者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
5 総括製造販売責任者の資格を証する書類
6 組織図: 法人の場合
7 品質管理に係る体制に関する書類。
<品質保証責任者の資格要件(再生医療等製品)>
医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令
一 品質保証部門の責任者であること。
二 品質管理業務その他これに類する業務に3年以上従事した者であること。
三 品質管理業務を適正かつ円滑に遂行しうる能力を有する者であること。
四 医薬品等又は医療機器の販売に係る部門に属する者でないことその他品質管理業務の適正かつ円滑な遂行に支障を及ぼすおそれがない者であること。
8 製造販売後安全管理に係る体制に関する書類。
<安全管理責任者の資格要件(再生医療等製品)>
一 安全管理統括部門の責任者であること。
二 安全確保業務その他これに関する業務に3年以上従事した者であること。
三 安全確保業務を適正かつ円滑に遂行しうる能力を有する者であること。
四 医薬品等の販売に係る部門に属する者でないことその他安全確保業務の適正かつ円滑な遂行に支障を及ぼすおそれがない者であること。
9 配置図: 同一敷地内の建物及び建物内の自社と他社の使用部分を示したもの
10 事務所の平面図: 製造販売業として使用するフロアの図面
11 保管設備に関する図面
12 最寄りの駅から事務所までの地図を添付
書類を添付省略できる場合
次の書類については、都知事あてに他の申請書・届出に添付し、提出済みの場合は添付を省略することができます。
①登記事項証明書
②責任役員の診断書
③総括製造販売責任者の資格を証する書類
④総括製造販売責任者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
再生医療等製品 製造業 許可 を 申請
再生医療等製品の製造業については関東信越厚生局へ問い合わせます。
再生医療は未だに特殊な分野なので、都道府県でなく厚生労働省やその外部機関が審査を担当します。
再生医療等製品 販売業 許可 を 申請
再生医療等製品販売業とは、業として再生医療等製品を、再生医療等製品の製造販売業者、製造業者若しくは販売業者又は病院、診療所若しくは飼育動物診療施設の開設者などに対し販売等を行うための許可です。
再生医療等製品の販売業者には、生命・健康にかかわる再生医療等製品を取り扱う事業者として、品質等に問題のある再生医療等製品の流通や再生医療等製品の不正流通による保健衛生上の危害が生じないよう、高い倫理観を持ち、薬事に関する法令を遵守して業務を行うことが求められています。
再生医療等製品 販売業 許可 が不要な場合
- 再生医療等製品の製造販売業者が、その製造・輸入した再生医療等製品を、再生医療等製品の製造販売業者・製造業者・販売業者に販売・授与する場合や、販売・授与の目的で貯蔵・陳列する場合
- 厚生労働大臣が指定した再生医療等製品の製造販売業者が、その製造・輸入した再生医療等製品を、医師・歯科医師・獣医師、病院・診療所・飼育動物診療施設開設者に販売・授与する場合や、販売・授与の目的で貯蔵・陳列する場合
- 再生医療等製品の製造業者が、その製造した再生医療等製品を、再生医療等製品の製造販売業者または製造業者に販売・授与する場合や、販売・授与の目的で貯蔵・陳列する場合
標準処理期間、申請手数料
許可の有効期間は6年で、6年ごとに更新する必要があります。5年ではありません。
標準処理期間は、新規申請・更新申請に関することは10日。なお、書類の不備等が整うまでに費やした日数は含まれません。
申請手数料は、新規許可申請・・34,100円、許可更新申請・・12,400円 になります。
添付書類
参照:再生医療等製品販売業許可申請書(新規)の提出部数及び記載上の注意
☆ 平 面 図
1 営業所の構造設備の概要(配置図)を記載し、貯蔵設備を明示します。
2 営業所がビル等の場合は、階数又は部屋番号等を明記し、営業所の電話番号を記載します。
3 個人の居宅等と併設する場合は、常時居住する場所との明確な区別が必要です。
4 営業所(貯蔵設備も含む。)の寸法及び面積を記載してください。
☆ 登記事項証明書(申請者が法人の場合)
1 原則として、法人の目的に「再生医療等製品の販売」等に関する業務の記載が必要です。
2 6か月以内に発行されたものが有効です。
☆ 開設者の診断書 :申請者(申請者が法人であるときは、薬事に関する業務に責任を有する役員)が精神の機能の障害により業務を適正に行うに当たって必要な認知、判断及び意思疎通を適切に行うことができないおそれがある者である場合のみ
☆ 証 書(使用関係を証明する書類) :管理者が申請者(法人の場合も含む。)に雇用されている場合に添付が必要です。
☆5 管理者の資格証明書
- 再生医療等製品 外国製造業者の「 認定 」申請
認定とは、外国において日本に輸出される再生医療等製品を製造しようとする者を、薬機法における再生医療等製品外国製造業者といい、 国内製造業者の許可と同様に、外国製造業者が医薬品医療機器法第23条の24による認定を受けていることが当該再生医療等製品の製造販売承認の要件となっています。
外国において本邦に輸出される再生医療等製品を製造しようとする者(以下「再生医療等製品外国製造業者」という。)は、厚生労働大臣の認定を受けることができる。
2 前項の認定は、厚生労働省令で定める区分に従い、製造所ごとに与える。
薬機法 第23条の24項
外国製造業者の認定権者は厚生労働大臣であり、認定のための外国製造所の構造設備の調査は機構が行います。認定は、区分に従って、製造所ごとに与えられます。区分の説明は後に続きます。
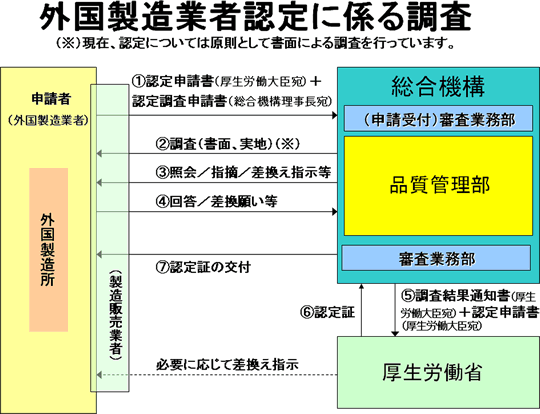
認定 申請 に必要な添付書類
製造所の責任者の履歴を記した書類や、製造品目の一覧表及び製造工程に関する書類、加えて製造所の構造設備に関する書類などを準備します。
法第23条の24第1項の規定による再生医療等製品外国製造業者の認定を受けようとする者は、同条第3項において準用する法第23条の22第3項の規定により、様式第十八による申請書(正副二通)を提出するものとする。
2 法第23条の24第3項において準用する法第23条の22第3項第五号の厚生労働省令で定める事項は、次のとおりとする。
一 製造所の名称及び所在地
二 認定の区分
3 第1項の申請書には、次に掲げる書類を添えなければならない。ただし、申請等の行為の際厚生労働大臣に提出された書類については、当該申請書にその旨が付記されたときは、この限りでない。
一 製造所の責任者の履歴書
二 製造品目の一覧表及び製造工程に関する書類
三 製造所の構造設備に関する書類
四 当該再生医療等製品外国製造業者が存する国が再生医療等製品の製造販売業の許可、製造業の許可、製造販売の承認の制度又はこれに相当する制度を有する場合においては、当該国の政府機関等が発行する当該制度に係る許可証等の写し
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則 第137条の19
外国製造業者 の 認定 の区分
外国製造業者の認定の区分は、製造するものによって4つに分類されています。さらに各分類は製造工程等によって、複数種類の区分に分けられます。
①医薬品(体外診断用医薬品を除く)・・・5種類の区分
②体外診断用医薬品・・・3種類の区分
③医薬部外品・・・3種類の区分
④医療機器・・・4種類の区分
再生医療等製品は概ね、①医薬品(体外診断用医薬品を除く)の5種類のうちで、生物学的製剤等に該当します。
1.生物学的製剤等:生物学的製剤、国家検定医薬品、遺伝子組換え技術応用医薬品、細胞培養技術応用
医薬品、細胞組織医薬品、特定生物由来製品の製造工程の全部又は一部を行うもの
2.放射性医薬品 :放射性医薬品の製造工程の全部又は一部を行うもの
3.無菌医薬品:無菌医薬品の製造工程の全部又は一部を行うもの
4.一般 :3号に掲げる医薬品以外の医薬品の製造工程の全部又は一部を行うもの
5.包装・表示・保管 :包装、表示又は保管のみを行うもの
認定 に必要な標準的事務処理期間
明記されたものはありませんが、国内の大臣許可製造所に対する許可について、 申請から許可までの事務処理期間の目安を概ね5か月程度としていることから、外国製造業者の認定についても、申請から5ヶ月程度を目安とされます。
認定 に必要な費用
新規認定申請では、下記①及び②を併せて独立行政法人医薬品医療機器総合機構(PMDA)に提出し、費用を支払います。
①外国製造業者 認定 申請書 148,100円
②外国製造業者 認定 調査申請書 148 100円
再生医療等製品の種別許可数の推移
直近の2022年でも製造販売業の許可数は18社,製造業で26社であって、医療機器等と比べても3種類で3,000社弱に比べても少ない状態です。設備等が大規模になり、民間では採算ベースにのらないためでしょう。
国立大学法人東京大学は2023年3月20日、国立大学法人として初めて、「再生医療等製品」製造業許可を取得しました、との記事がありました。研究段階ですと仕方がないのかもしれませんが、具体的な製品化によって裾野を広げていくことも可能です。
新規製品の数も一桁が続いています。
| 再生医療製品のデータ | 2021年 | 2022年 |
| 令和3年 | 令和4年 | |
| 製造販売業の許可数 | 16社 | 18社 |
| 製造業の許可数 | 24社 | 26社 |
| 製造販売の製品承認数 | 5件 | 4件 |
| 製造販売承認事項一部変更承認 | 8件 | 14件 |
再生医療等製品の不具合等報告数の推移
| 年度 | 製造販売業者からの報告 (単位:件) | 医薬関係者からの不具合報告(単位:例) | ||||
| 不具合報告 注1) | 研究報告 | 外国措置報告 | 感染症定期報告 | |||
| 30年度 | 163 | 0 | 0 | 34 | 0 | |
| 31(令和元)年度 | 1,145 | 1 | 2 | 62 | 0 | |
| 令和2年度 | 1,951 | 1 | 6 | 74 | 6 | |
| 令和3年度 | 2,390 | 2 | 7 | 100 | 5 | |
| 令和4年度 | 3,063 | 0 | 8 | 155 | 2 | |

再生医療等製品業 新規 申請 は 行政書士にご依頼ください
再生医療等製品業 新規 申請 は 行政書士にご依頼ください
以前には薬事法として薬中心でまとめられていましたが、薬機法は正式名称を「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」と言うように、医療機器や安全性なども吸収して大きく管理する仕組みとなりました。医薬品等は人の生命や健康に直接関わるものです。そのため、薬機法では医薬品等の品質不良や虚偽・誇大広告などによる、国民の健康被害を防ぐことを目的に、製造や販売、製品の表示・広告に至るまで厳しい規制が設けられています。
今回の再生医療等製品においても、似たような性質を持つ医薬品、医薬部外品、化粧品、医療機器、再生医療等製品の5業種がおおよそ同じ体系で管理されています。
化粧品はドラッグストアやコンビニでも販売されるようになり、ますます身近な商品になってきましたので取り扱う業界が広がっています。
参考記事: 化粧品製造販売業 許可申請
2013年、文部科学省から再生医療研究全体に対して10年間で1100億円規模の長期的な支援を行うと発表され注目を集めました。これによってiPS細胞などを使った再生医療に関する研究や、病気の仕組みの解明や薬を作る研究を支援するプログラムが注目を集めてきました。山中教授のノーベル賞受賞など日本が先端を走ってきた最も熱い業界ですので、日本企業の発展と活躍も期待されます。
法律の専門家である行政書士は、再生医療等製品の許可申請だけにとどまらず、5年ごと(販売業は6年)の更新や、その間の法律的な変更への対応など、継続的なお手伝いをさせていただきます。さらに要件や審査が厳しいが収益が高いと言われる医薬品業など、隣接した業界への進出などもアドバイス可能です。
医薬業界は、薬機法で統括されています。薬機法は医薬品等の品質や有効性、安全性を確保し、保健衛生の向上を目的とした法律です。昨今の薬機法改正などで規制緩和が進み、医薬業界も行政手続きをすればビジネスを拡大していける可能性が広がりました。皆様の起業や事業拡大の要望を実現に向けてお手伝いいたします。

申請ALL. com での 再生医療等製品業 許可の見積もりの探し方
当サイト 申請ALL.com は登録不要で行政書士見積もりを自動でお示しする便利なサイトです。
- 画面右下のチャットボットを開く
- 業務分類から”その他のご相談”をクリック
- その他の業務の中から”医薬品・化粧品”をクリック
- 医薬品・化粧品(薬機法関連)の中から対象分野を選択
- その後必要事項を選択し、簡単な質問に答えるだけで、自動でお見積もりが表示されます。
チャットを途中で離脱した場合など、過去の「キャッシュ」が残っていると、スタート画面に戻れない場合があります。
一度、キャッシュを削除して、最初からチャットをスタートしてください。
過去のキャッシュを削除する方法は『申請ALL.comの キャッシュを削除するには?』をご覧ください

開業支援も行政書士にご依頼ください
開業を控えたお客様もご活用ください。
当サイト 申請ALL.com は全ての行政手続にワンストップ対応します。
化粧品製造販売業許可のみならず、会社設立や資金調達、契約書等の書類の作成なども行います。
参考記事:会社設立 ~ 株式会社設立


