医薬品業 は、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下、薬機法)」により規制されているため、国内で製造した医薬品を販売・授与するためには、通常、医薬品製造販売業許可及び医薬品製造業許可(登録)が必要となります。
会社としての許可(登録)のほかに、原則、取り扱う品目ごとに医薬品製造販売承認(認証)を取得する必要があります。
最近の医薬品事情を交えて、医薬品業の更新についてご紹介します。

医薬品業 許可 4種類
医薬品とは、薬機法 第2条第1項に次の3点でまとめられています。更に要約すると、薬局で処方され売られる薬と病院内で使用する医療品になります。医薬品が機械器具ではないのは当然としても、同じ哺乳類同士であるためか動物用であっても同じ対象になります。
(1)日本薬局方に収められている物
(2)人又は動物の疾病の診断、治療又は予防に使用されることが目的とされている物であって、機械器具等でないもの(医薬部外品は除く)
(3)人又は動物の身体の構造又は機能に影響を及ぼすことが目的とされている物であって、機械器具等でないもの(医薬部外品及び化粧品は除く)
さて、簡単に必要な許可などを列挙すると、以下の4つになります。
国内で製造した医薬品を販売・授与するためには、以下の3つが通常必要になります。
①医薬品製造販売業許可:製品出荷が目的
②医薬品製造業許可(登録):製品の製造が目的
③医薬品製造販売承認(認証):取り扱う品目ごとに必要
中には、製造販売の承認を要しない医薬品もありますし、製造はしない、自社ブランドでは扱わないなど、更に限定されることもあります
海外から輸入した医薬品を販売・授与するためには、上記の国内に加えて、
④外国製造業者認定:海外の製造者や工場を審査
製造業者は、製造販売業者の委託を受け、製品を製造する者であり、製造所毎に、行う工程に応じた区分の許可を取得する必要があります。
医薬品の中身に関わる製造業者は許可を取得し、製造過程の一部である包装・表示・保管のみを行う場合には簡単な登録で済ませることができます。ただし、製造業の許可では製品を市場に出荷することができません。
出荷のためには、製造販売業の許可が必要になります。出荷とは、自社ブランドやラベルで製品を流通させ、製品の責任を負うことです。製品は、製造⇒製造販売⇒販売の会社を通じて流通していきます。
また、販売を担当するには、以下のような2種類の許可があります。
医薬品製造販売業の許可の種類は扱う医薬品に応じて分かれ、処方箋薬を扱えるのが薬局、扱えないのがドラッグストア等となります。
・第一種医薬品製造販売業:厚生労働大臣の指定する医薬品(処方せん医薬品)
・第二種医薬品製造販売業:第一種に該当する医薬品以外の医薬品(処方せん医薬品以外の医薬品)
医薬品業 の 許可 数
医薬品等の製造販売業許可数と医薬品等の製造業許可・登録数の一覧です。2020年から2022年なのでコロナの影響が大きく、推移をみるには不十分ですが、医薬品、医薬部外品、化粧品で許可件数が異なったり、製造販売と製造でも医薬品では倍くらい製造が多い特徴がみられます。
以下の許可数や登録数は、2022年末時点での残数となっています。
医薬品等の製造販売業許可数
| 種別 | 医薬品 | (第1種医薬品) | (第2種医薬品) | 医薬部外品 | 化粧品 | 計 |
| 製造販売業 2022年末 | 1,040 | 282 | 758 | 1,543 | 4,209 | 6,792 |
| 製造販売業 2020年末 | 1,037 | 274 | 763 | 1,458 | 3,957 | 6,452 |
医薬品等の製造業許可・登録数
| 区 分 | 医薬品 | 医薬部外品 | 化粧品 | 計 |
| 製 造 業 2022年 | 2,091 | 2,122 | 4,174 | 8,387 |
| 製 造 業 2020年 | 2,047 | 1,958 | 3,876 | 7,881 |
医薬品関係で製造や出荷に関わる会社数は、安定的に推移していると見られます。高齢化で医療にかかる支出は増えるとはいえ、人口も減少傾向にあり、国も医療費削減で薬価などを引き下げている状況なので国内市場が大きく伸びる余地は限られます。薬局から併設型のドラッグストアへ、ネット通販へといった販売チャネルの変更は大いに想像できますが、コロナでのマスク需要のような突発的な需要を除けば、製造での変更は乏しそうです。
海外の薬事情|個人輸入のリスクや注意点を徹底解説
近年インターネットサイトを経由して、日本製だけでなく海外からも容易に薬を手に入れることができるようになりました。海外の薬は安心して使用できるものなのでしょうか。日本の厚生労働省は海外から薬を購入するときの注意を促しています。
参考:健康食品の海外からの購入について、厚生労働省
医薬品などの輸入は、不正に国内に流入することを未然に防止し、また、国民の保健衛生上の危害防止の観点から、薬事法や関税法の規制を受けます。一般の個人が輸入(個人輸入)できるのは、自分自身で使用する場合に限られており、個人輸入した医薬品などを、ほかの人に売ったり、譲ったりすることは認められません。
個人輸入には、原則として、地方厚生局(厚生労働省の地方支分部局)に必要書類を提出し、薬事法に違反する輸入でないことの証明(「薬監証明」)を受ける必要がありますが、以下の範囲内であれば、特例的に「税関限りの確認」で通関することができます。
日本の薬事情
日本では政府が薬の効能と無害性を保証し、何かおきた際には保障する体制が整っています。その体制を担うのは、医薬品医療機器総合機構(PMDA)。厚生省の外郭団体になります。
現在の法律では国内で一般的に流通している医薬品や医療機器は、PMDAの承認を受けなければいけないとされています。審査・承認にあたっては国内外で開発・販売された医薬品や医療機器を日本人に使用しても問題ないかという、人種・体格差による有害性がないかも調べているのです。
現在、国内で流通しているOTCと処方箋医薬品を合わせると、その数は約25000品目を超えます。ちなみにPMDAが承認する医療機器は、家庭で使用するコンタクトレンズ・マッサージ機・補聴器なども対象です。PMDAは膨大な数の医薬品や医療機器をチェックし、流通後のトラブルまで監視しているのです。
海外の薬事情
海外で販売・流通する薬の審査・承認は、日本ほど厳しくはありません。海外では患者には薬を選択する権利と自己責任が保障されている反面、副作用が問題になってもその責任は製薬会社と薬を選んだ患者にあるというスタンス、自己責任です。
国が薬を認可するシステムがあっても、もし副作用やトラブルが問題になったケースでも日本のように国が保証するシステムがない国がほとんどなのです。日本や先進国では、国が未認可の薬が流通していないか監視する体制が整っていますが、途上国はその監視体制も甘く、アジアやアフリカ・南米では流通する薬の30%程度が偽薬という驚きの報告もあります。
海外の薬を使用する際に、日本国内で流通する薬と同じように考え安易に使用するのは避けてください。近年、インターネットを通じて海外から薬を購入する、いわゆる個人輸入する人が増えています。さらに、旅行先で購入した医薬品や化粧品・医療機器を持ち帰ることも個人輸入に該当します。しかし、薬の個人輸入に関するさまざまな情報をお持ちでない方が少なくありません。
薬の個人輸入の基本ルール
インターネットサイトを利用しての購入、旅行の際にお土産として持ち帰る。いずれの方法でも、医薬品の個人輸入は「自分自身での使用のみ認められる」とされています。
販売目的で輸入する場合や一定の数量を超えて輸入する場合には、法律に基づいて厚生労働大臣や都道府県知事の承認と薬監証明書や輸入確認証の取得が必須です。
参考:医薬品等の輸入手続きについて 関東信越厚生局
特例として、以下の範囲内については税関の確認のみで輸入できます。
| 医薬品 | 外用薬 (毒薬、劇薬及び処方箋薬をのぞく) | 標準サイズで1品目24個以内 |
| 毒薬、劇薬又は処方箋薬 | 用法用量からみて1ヶ月分以内 | |
| 上記以外の医薬品・医薬部外品 | 用法用量からみて2ヶ月分以内 | |
| 化粧品 | 標準サイズで1品目24個以内 | |
| 医療機器 | 家庭用医療機器(電気マッサージ器など) | 1セット |
| 使い捨て医療機器(生理用タンポン、使い捨てコンタクトレンズなど) | 2ヶ月分以内 | |
| 体外用診断薬(排卵検査薬など) | 2ヶ月分以内 | |
| 再生医療等製品 | 用法・用量・使用方法からみて1か月分以内のもの | |
医薬品 海外への個人郵送
ビジネスでなくても、医薬品を海外に郵送する場合どのような規制があるのでしょうか。カナダに日本の薬を郵送した事例をご紹介します。
参照:カナダあて郵便物の送付について、郵便局
薬品は、ビタミン剤、ビタミン補助剤、軟膏、薬、処方箋薬、歯治療用接着剤、化粧品などを梱包して送れます。カナダは厳しい、と言われましたが、内容が厳しいというよりも、きちんと内容物を記載しないと開封されるという意味でした。
個人が使用する場合、法令で禁止されていない限り、四半期に一度三カ月分を輸入することができる。
- 処方箋薬については、薬剤師に調合され、薬局又は病院の薬包に梱包されている場合、単回投与分又は四半期に一度三カ月分が認められる。
- 個人使用を超える分量と見なされる場合、商業取引と見なされ、許可を得たもののみ輸入することができる。
- 具体的な医薬品名(例:風邪薬Cold Medicine、頭痛薬Headache Medicineなど ※商品名ではありません)を税関告知書に記載すること。
風邪薬、胃腸炎、花粉症などの一般的な日本の市販薬や漢方薬程度でした。
UBSで充電する電気カイロを郵便局の窓口で送付できないと取り出されたこと、お菓子類をたくさん入れ過ぎてカナダの税関で開封されたことなどがあります。お菓子類は多すぎると商業利用と誤解されてしまうようです。
結局は、内容の明細をしっかり書けば大丈夫ということで、Cold Medicineのタブレットとか、Headache Medicineの粉末、Hay feverのタブレット・・のように入力しました。しっかりと書けば大丈夫のようで、無事にカナダに到着しました。
未承認の 医薬品
医薬品・医薬部外品であっても、数量に関わらず厚生労働省の確認が必要な薬もあります。これらは未承認の医薬品や、医師の指導のもとに適切に使用しなければ健康被害のおそれがある薬、重大な健康被害のおそれがある医薬品成分が検出された薬などが該当します。
詳しくは、こちらの使用を参照ください。
参考:数量にかかわらず厚生労働省の確認を必要とする医薬品の改正について、厚生労働省
また国内では医薬部外品とみなされている養毛剤、浴用剤、ドリンク剤、サプリメントやビタミン剤も製品によっては医薬頻成分が含まれていたり、医薬品と同等の効果・効能をうたっている場合には、医薬品に該当する可能性があるため注意が必要です。
さらに麻薬や向精神薬、医薬品覚せい剤原料については、医師から処方された本人が携帯して入国する場合を除いて、個人輸入は禁止されています。これらの薬物については、誰かに依頼して持ち込んでもらう、インターネット通販で取り寄せることも禁止されていて、違反すると処罰の対象となります。
引用:医薬品等の個人輸入について、厚生労働省
最近でも、タイから輸入したグミキャンディーに大麻の成分が含まれていた事件がありました。海外では大麻が解禁になっている国も多く、普通の原料として禁止成分が含まれる可能性もあります。
後発薬メーカー不正事件で製品供給に障害
昨年2023年の秋には、後発薬大手の沢井製薬が、製造する胃潰瘍や急性胃炎向けの後発薬で、厚生労働省に提出した承認書とは異なる方法で品質試験をしていたと発表しました。2015年以降、不正が続いていたようです。同じ頃には自動車でもダイハツの認証試験での不正が報じられていましたので、構造的に不正を強いられてきたのか、さては安全にこだわりすぎて採算に合わなくなってきていたのかなど、様々な要因が推測されます。
サワイグループホールディングス(GHD)傘下で後発薬大手の沢井製薬は23日、九州工場(福岡県飯塚市)で製造する胃潰瘍や急性胃炎向けの後発薬で、厚生労働省に提出した承認書とは異なる方法で品質試験をしていたと発表した。2015年以降、不正が続いていた。後発薬では他社でも品質不正が相次いでおり、信頼の回復が求められている。
不正があったのは「テプレノンカプセル50ミリグラム(サワイ)」。製造後3年が経過した薬のカプセルが、胃の中で問題なく溶け出すかを調べる試験(溶出試験)で不正があった。カプセルに入っている中身を取り出し、別の新しいカプセルに詰め替えて試験していたという。
23日の記者会見で沢井製薬の木村元彦社長は、23年4月に不正が発覚したと説明した。6月に外部の専門家や弁護士を含む特別調査委員会を立ち上げ、10月20日に報告書を受け取った。7月には使用期限内のすべてのテプレノンを回収したとしている。
参照ニュース:沢井製薬、胃炎薬で試験不正 2015年から継続的に、日本経済新聞、2023年10月23日
後発薬では、3年前から他社でも品質不正が相次いでおり、一連の問題の発端となったのは、おととし2020年12月に発覚した福井県のジェネリック=後発医薬品メーカー「小林化工」が製造した水虫などの真菌症の治療薬に睡眠導入剤の成分が混入した不祥事でした。この1年余りの間に各地のメーカーが業務停止命令の処分を相次いで受ける異例の事態となっています。
参照ニュース記事:製薬会社の行政処分相次ぐ メーカーに何が? NHK、2022年5月15日
厚生労働省でも、2022年に第1回 医薬品の迅速かつ安定的な供給のための流通・薬価制度に関する有識者検討会を開催し、医療費の削減のため後発薬の活用が爆発的に伸び、現在では80%にも達するものの、薬価の抑制が厳しいので採算が取れずにいる中小の製薬メーカーの状況や、大半が製造委託の歪んだ状況、中小企業がひしめくなど問題点を指摘しています。
○ ジェネリック(後発薬)医薬品の保険収載品目数別メーカー数(計192社)
(令和2年8月26日現在)
・ 500品目以上 : 3社 東和薬品、沢井製薬、日医工
・ 300~499品目: 3社 武田テバファーマ、ニプロ、共和薬品工業
・ 200~299品目: 8社
・ 100~199品目: 17社
・ 50~ 99品目: 10社
・ 40~ 49品目: 4社
・ 30~ 39品目: 14社
・ 20~ 29品目: 17社
・ 10~ 19品目: 25社
・ 1~ 9品目: 91社
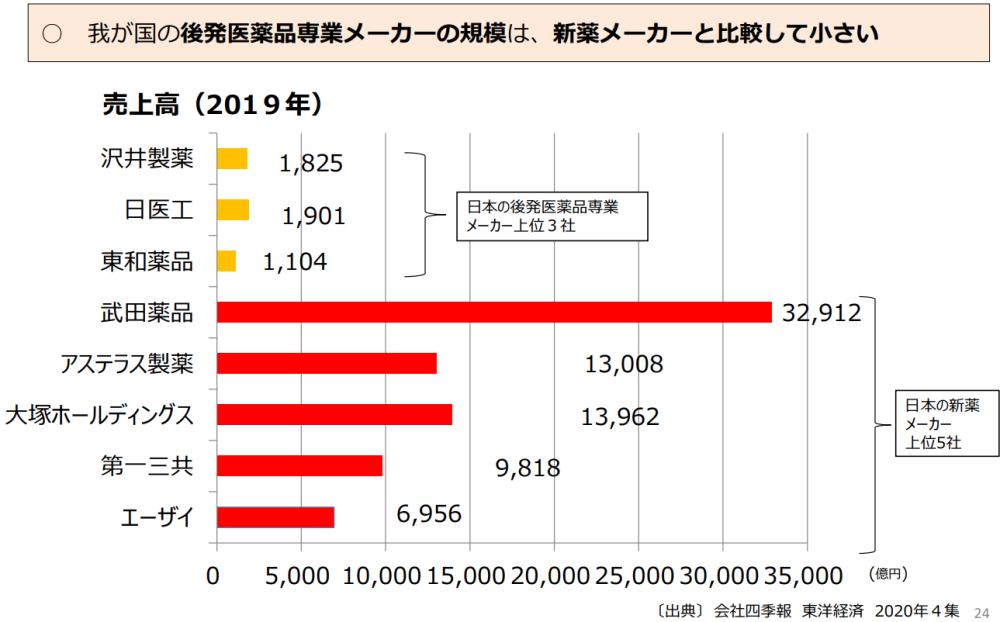
参照:医薬品業界の概況について、厚生労働省 医政局、令和4年8月31日
新薬の開発を多額の研究開発費を使って行い、新薬発売で回収していく新薬メーカーと、後発薬専業メーカーとで売上の差があったとしてもビジネス構造の違いであって問題なのか分かりません。武田製薬のように外国での事業規模が大きく日本の製薬メーカーとは言い難い会社もありますし、他の製薬メーカーにしても外資の傘下にあったりと純粋に国内製造販売の後発薬メーカーとは比較できません。
薬の輸入品の話にも出ましたが、日本では政府が薬の効能と無害性を保証し、何かおきた際には保障する体制が整っています。その体制を担うのは、医薬品医療機器総合機構(PMDA)で、医薬品医療機器等法という法律に基づいて医薬品や医療機器の安全性や有効性を審査・承認するだけでなく、健康被害救済や安全対策を担当しています。海外でもPMDAのような機関が薬の審査・承認をする国は少なくありませんが、アメリカのFDAのように、ただし認可薬の効能と安全性を保証する国はとてもまれです。
PMDAのおかげで審査・承認にあたっては国内外で開発・販売された医薬品や医療機器を日本人に使用しても問題ないかという、人種・体格差による有害性がないかも調べているのです。後発薬についても、沢井製薬が異なる方法で品質試験をしていたのが違反とされたように、厳しすぎる安全基準が手抜き試験につながっていた面もあります。
医薬品店舗販売業 更新
さて、医薬品店舗販売業の更新手続きついて解説します。東京都大田区の事例になります。
更新申請は、許可有効期間の終期の1ヶ月前を目安に申請します。提出書類は店舗販売業許可更新申請書と、添付書類として現在お持ちの許可証と、診断書(申請書中の欠格条項に該当する場合のみ提出)のふたつになります。
更新の手数料は12,700円(現金のみ)。
以下のような変更があった場合には30日以内に変更届を提出するように指示があります。
医薬品店舗販売業の変更届
以下の内容に変更が生じた場合は、変更届と変更事項に応じた添付書類を提出ください。添付書類(証書や資格免許書等)について、大田区内の他の店舗で提出済みの場合は省略することができます。その場合は、変更届の備考欄に提出した店舗の名称、所在地、提出年月日を記載してください。
以下の事項に変更があった場合は、変更届と添付書類を事後30日以内に提出します。
- 管理者
- 勤務薬剤師・勤務登録販売者
- 週当たりの勤務時間数
- 勤務薬剤師・登録販売者の氏名
- 管理者の住所
- 開設者の氏名・住所
- 責任役員(法人のみ)
- 構造変更
- 営業日及び営業時間
- 取り扱う医薬品の区分
登録販売者の確認
2009年までは医療用医薬品・一般用医薬品ともに、薬剤師による対面販売をしていました。薬事法の改正で、一般用医薬品は、薬剤師でなくても登録販売者によって販売できるようになり、情報提供は努力義務となったのです。
登録販売者とは、一般用医薬品の販売資格を有する人を指します。年1回実施される試験に合格すれば誰でもなれます。月に80時間以上勤務で2年以上の実務経験があれば正式な登録販売者として認められ、1人で店頭に立つことができます。
登録販売者が第2類医薬品または第3類医薬品を販売・授与する店舗の店舗管理者になるためには、以下のいずれかの要件を満たす必要があります。
- 過去5年間のうち、薬局・店舗販売業等における従事期間の合計が通算して2年以上ある
【従事期間】月単位で計算し、1か月に80時間以上業務(実務)に従事した場合に認められる。また、過去5年間のうち、月当たりの時間数にかかわらず月単位で従事した期間が通算して2年以上あり、かつ、過去5年間において、合計1920時間以上従事した場合も認められる - 過去5年間のうち薬局・店舗販売業等における従事期間が通算して1年以上であり、法令で定める研修を修了している
【従事期間】月単位で計算し、1か月に160時間以上従事した場合に認められる。また、過去5年間のうち、月当たりの時間数にかかわらず月単位で従事した期間が通算して1年以上あり、かつ、合計1920時間以上従事した場合も認められる - 薬局・店舗販売業等における従事期間(平成21年6月1日以降に限る)が通算して1年以上であり、かつ、過去に店舗管理者または区域管理者として業務に従事した経験がある
【従事期間】月単位で計算し、1か月に160時間以上従事した場合に認められる。また、過去5年間のうち、月当たりの時間数にかかわらず月単位で従事した期間が通算して1年以上あり、かつ、合計1920時間以上従事した場合も認められる - 薬局・店舗販売業等における従事期間(平成21年6月1日以降に限る)が通算して5年以上あり、かつ、法令で定められた研修を通算して5年以上受講している(当分の間の経過措置)
【従事期間】月単位で計算し、1か月に80時間以上業務(実務)に従事した場合に認められる。また、過去5年間のうち、月当たりの時間数にかかわらず月単位で従事した期間が通算して5年以上あり、かつ、合計4800時間以上従事した場合も認められる
医薬品店舗販売業 更新申請 は 行政書士 にご依頼ください
医薬品店舗販売業を中心に解説しましたが、製造業であれ製造販売業であれ飽和したように見えて可能性に溢れています。小林製薬の紅麹サプリ問題で、紅麹の回収騒ぎが浮かび上がったのは、医薬品、食品、飲料などが紅麹を原料として様々な商品を開発している現状です。必ずしも製薬メーカーだから薬機法ではなく、消費者庁が監督する健康サプリも作れば、原料として酒造メーカーなど他の業種にも販売する。こうした原材料を通じたクロスボーダーな世界であり、国境を越えた輸出入にも通じます。
参考記事:小林製薬の 紅麹サプリ に見る機能性食品と 薬機法
こうした観点から記事を作成してみましたが、薬機法や法律関係でのサポートや、事業と許可等との関係などの相談まで、行政書士にご相談ください。

申請ALL. com での 医薬品業 許可の見積もりの探し方
当サイト 申請ALL.com は登録不要で行政書士見積もりを自動でお示しする便利なサイトです。
- 画面右下のチャットボットを開く
- 業務分類から”その他のご相談”をクリック
- その他の業務の中から”医薬品・化粧品”をクリック
- 医薬品・化粧品(薬機法関連)の中から対象分野を選択
- その後必要事項を選択し、簡単な質問に答えるだけで、自動でお見積もりが表示されます。
チャットを途中で離脱した場合など、過去の「キャッシュ」が残っていると、スタート画面に戻れない場合があります。
一度、キャッシュを削除して、最初からチャットをスタートしてください。
過去のキャッシュを削除する方法は『申請ALL.comの キャッシュを削除するには?』をご覧ください

開業支援も行政書士にご依頼ください
開業を控えたお客様もご活用ください。
当サイト 申請ALL.com は全ての行政手続にワンストップ対応します。
医薬品業許可のみならず、会社設立や資金調達、契約書等の書類の作成なども行います。
参考記事:会社設立 ~ 株式会社設立


