化粧品はドラッグストアやコンビニでも販売されるようになり、ますます身近な商品になってきました。消費者への販売業者としての最終小売り店だけは、特別な許可は必要ありませんが、販売業者に至る全ての過程で、化粧品の製造販・製造・輸入には許可が必要です。 化粧品製造販売業許可 について手続きの専門家の立場で概略を説明します。
化粧品製造業者 と 化粧品製造販売業者 の2種類の許可は、これを受ける事務所や製造所の所在地の都道府県知事が取り扱います。ここでは、断りが無いときには東京都での取り扱いについて説明します。

化粧品で必要となる2種類の許可
化粧品を国内で製造(包装・表示・保管のみを行う場合を含む)するためには、「化粧品製造業者」の許可が必要です。さらに、「化粧品製造販売業者」は、製品を市場に出荷(卸売業者や消費者に販売・賃貸・授与)するための許可を持っています。
そして、国内で販売される化粧品は、「化粧品製造販売業者」の名称が商品に記載されている必要があります。
化粧品は、医薬品・医薬部外品・医療機器と同様に「薬機法」にて規制されているため、国内製造又は輸入した化粧品を販売・授与するためには、通常、次の許可が必要となります。
化粧品製造業許可と化粧品製造販売業許可の2種類の許可は、違う会社が取得することもできますが、化粧品の直接の容器等には「化粧品製造販売業者」の氏名を記載しなければなりません。
薬機法とは?
薬機法とは、医薬品や医薬部外品、化粧品、医療機器、再生医療等製品について、開発・承認・製造・販売・広告などに関する規制を定めた法律です。
薬機法は正式名称を「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」といい、「医薬品医療機器等法」や、以前の通称である薬事法に合わせて「薬機法」と略されます。
2019年11月に薬機法は改正され、医薬品と医療機器を区分して再生医療等製品の規定したり、これまでも話題になっていた一般用医薬品のインターネット販売解禁などを決め、医薬品、医薬部外品、化粧品、医療機器の広告規制も厳格にしました。
参考記事:医薬部外品 の 許可申請
化粧品とは?
化粧品とは、人の身体を清潔にする、皮膚や毛髪を健やかに保つといった目的のために、身体に塗るなどして使用するものを指します。
薬機法において化粧品は、次のように定義されています。
この法律で「化粧品」とは、人の身体を清潔にし、美化し、魅力を増し、容貌ぼうを変え、又は皮膚若しくは毛髪を健やかに保つために、身体に塗擦、散布その他これらに類似する方法で使用されることが目的とされている物で、人体に対する作用が緩和なものをいう。ただし、これらの使用目的のほかに、第1項第二号又は第三号に規定する用途に使用されることも併せて目的とされている物及び医薬部外品を除く。
薬機法 第2条第3項
化粧品に該当するものは、スキンケア・メイクアップ用品、シャンプーや石けんなど多岐にわたります。しかし、化粧品としての効能や効果は定められた範囲があるため、医薬品のように広告をうたうと、薬機法違反になります。

2種類の許可の場合分け
また、許可後には、国内外で取り扱う化粧品ごとに届出が必要です。
A)国内の工場で製品を製造して出荷する場合:中身の製造を含む場合になります
ア 化粧品製造業許可(許可区分:一般)
イ 化粧品製造販売業許可
B)海外から輸入した製品を出荷する場合:製造はないが、海外で法定事項を表示する場合も含みます。
ア 化粧品製造業許可(許可区分:包装・表示・保管)
イ 化粧品製造販売業許可
Bで輸入した化粧品を包装・表示・保管する場合のみでも、化粧品製造業の許可が必要です。ただし、保管だけの場合には、条件もありますが登録で済ませる簡易な制度もあります。
「製造販売業許可」は、製品を市場に出荷(卸売業者や消費者に販売・賃貸・授与)するための許可です。
この許可では製造(包装・表示・保管のみを行う場合を含む)することはできません。
「製造業許可」は、製品の製造を行うための製造所ごとの許可です。
この許可では製品を市場に出荷することができません。
”製造”業者 ⇒ ”製造販売”業者⇒ 販売業者(小売り)
つまり、製造は製品のみならずパッケージやラベルも含めたすべての行程を含み、自身の社名等を入れて小売店頭の販売業者に渡します。化粧品では、販売業者(小売り等)は許可不要であり、許可が必要な医薬品とは異なります。

製造業許可にも2種類あり
製造業許可では、中身にも関わる一般の許可区分と、中身に関わらない包装・表示・保管の許可区分の2種類に分かれます。
法第13条第2項に規定する厚生労働省令で定める化粧品の製造業の許可の区分は、次のとおりとする。
一 化粧品の製造工程の全部又は一部を行うもの(次号に掲げるものを除く。)
二 化粧品の製造工程のうち包装、表示又は保管のみを行うもの
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則 第25条第3項
さらに、包装・表示・保管の許可区分では、保管のみを行う場合には、許可でなく負担の軽い登録で済むことになりました。
法第13条の2の2第1項の医薬品、医薬部外品及び化粧品の製造工程のうち保管のみを行う製造所に係る登録の申請を行おうとする者は、同条第3項の規定により、様式第17の2による申請書を令第80条の規定により当該登録の権限に属する事務を行うこととされた都道府県知事に提出するものとする。
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則 第34条の3
申請者(法人の場合は役員)の欠格条項
申請者が、第5条第三号(イ)から(ト)までのいずれかに該当するときは、許可が得られません。
イ 第75条第1項の規定により許可を取り消され、取消しの日から3年を経過していない者
ロ 第75条の2第1項の規定により登録を取り消され、取消しの日から3年を経過していない者
ハ 禁錮以上の刑に処せられ、その執行を終わり、又は執行を受けることがなくなつた後、3年を経過していない者
ニ イからハまでに該当する者を除くほか、この法律、麻薬及び向精神薬取締法(昭和28年法律第14号)、毒物及び劇物取締法(昭和25年法律第303号)その他薬事に関する法令又はこれに基づく処分に違反し、その違反行為があつた日から2年を経過していない者
ホ 麻薬、大麻、あへん若しくは覚醒剤の中毒者
ヘ 心身の障害により薬局開設者(製造販売業者・製造業者)の業務を適正に行うことができない者として厚生労働省令で定めるもの
厚生労働省令で定める者は、精神の機能の障害により薬局開設者の業務を適正に行うに当って必要な認知、判断及び意思疎通を適切に行うことができない者とする。(施行規則第8条)
ト 薬局開設者(製造販売業者・製造業者)の業務を適切に行うことができる知識及び経験を有すると認められない者

化粧品製造販売業許可 許可申請ポイント
「製造販売業許可」は、製品を市場に出荷(卸売業者や消費者に販売・賃貸・授与)するための許可です。
総括製造販売責任者の選定が最重要で、品質管理の方法や製造販売後安全管理の整備が必要です。
申請時には、総括製造販売責任者の雇用契約書の写し又は雇用若しくは使用関係を証する書類が求められます。
総括製造販売責任者の設置
化粧品の製造販売業者は、厚生労働省令で定めるところにより、化粧品の品質管理及び製造販売後安全管理を行わせるために、化粧品の製造販売業者にあっては厚生労働省令で定める基準に該当する者を、置かなければならない。
医薬品、医薬部外品又は化粧品の製造販売業者は、厚生労働省令で定めるところにより、医薬品、医薬部外品又は化粧品の品質管理及び製造販売後安全管理を行わせるために、医薬品の製造販売業者にあつては薬剤師を、医薬部外品又は化粧品の製造販売業者にあつては厚生労働省令で定める基準に該当する者を、それぞれ置かなければならない。ただし、医薬品の製造販売業者について、次の各号のいずれかに該当する場合には、厚生労働省令で定めるところにより、薬剤師以外の技術者をもつてこれに代えることができる。
薬機法 第17条
総括製造販売責任者の基準
申請時には、総括製造販売責任者の資格を証する書類が求められます。
化粧品の品質管理及び製造販売後安全管理を行う者に係る法第17条第1項に規定する厚生労働省令で定める基準は、次の各号のいずれかに該当する者であることとする。
一 薬剤師
二 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する専門の課程を修了した者
三 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する科目を修得した後、医薬品、医薬部外品又は化粧品の品質管理又は製造販売後安全管理に関する業務に3年以上従事した者
四 厚生労働大臣が前三号に掲げる者と同等以上の知識経験を有すると認めた者
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則 第85条の2第2項
組織・各種文書・手順書の整備
品質管理の方法や、製造販売後安全管理(品質、有効性及び安全性に関する事項その他適正な使用のために必要な情報の収集、検討及びその結果に基づく必要な措置をいう。)の方法が、厚生労働省令で定める基準に適合しなければなりません。
GVP(Good Vigilance Practice)
製造販売後安全管理に係る体制に関する書類(GVP体制図) が必要です。
製造販売業者は、製造販売している医薬部外品・化粧品について、安全性の確保を行わねばなりません。
製造販売後安全管理の基準として、「医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令(「GVP省令」)」があります。
GQP(Good Quality Practice)
品質管理に係る体制に関する書類(GQP体制図)が必要です。
製造販売業者は、製造販売する製品について、適正な品質を確保するため、品質管理を行わなくてはなりません。
品質管理の基準として、「医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令(「GQP省令」)」があります。

化粧品「製造」業許可 (一部は登録が可能)
責任技術者の設置
化粧品の製造業者は、厚生労働省令で定めるところにより、化粧品の製造を実地に管理させるために、製造所ごとに、責任技術者を置かなければならない。
医薬部外品又は化粧品の製造業者は、厚生労働省令で定めるところにより、医薬部外品又は化粧品の製造を実地に管理させるために、製造所ごとに、責任技術者を置かなければならない。
薬機法 第17条 第10項
責任技術者の資格
製造販売業にあった総括製造販売責任者の基準と同じです。
申請時には、責任技術者の資格を証する書類が求められます。
一 薬剤師
二 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する専門の課程を修了した者
三 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する科目を修得した後、医薬品又は化粧品の製造に関する業務に3年以上従事した者
四 厚生労働大臣が前三号に掲げる者と同等以上の知識経験を有すると認めた者
申請する許可区分の検討
製造工程を検討して、どの許可区分の申請が必要か決定します。
化粧品の製造業の許可の区分は、大きくは以下の2種類です。
1)製造工程の全部又は一部を行うもの(次号に掲げるものを除く。)(許可区分:一般)
2)製造工程のうち包装、表示又は保管のみを行うもの(許可区分:包装・表示・保管)
一般か、包装・表示・保管かの2社から選択、さらに後者の場合には保管のみかどうかも決めます。
3)製造工程のうち保管のみを行うもの(登録区分:保管)
上記の区分については以下で詳細を説明しています。
製造業で保管のみの「登録」について
令和3年8月1日の法改正により、医薬品、医薬部外品又は化粧品の製造業について、「許可」に加え、新たに「登録」の制度が設けられました。
「登録」は、製造工程のうち「保管のみ」を行う製造所であって、下記①~④の条件のすべてに該当する場合のみ対象となります。
①保管(保管のために必要な検査等を含む。)のみを行う製造所である。
②包装、表示その他の製造行為又は試験検査(当該製造業者の他の試験検査設備又は他の試験検査機関を利用して行う場合を含む。)を行う製造所ではない。
③最終製品(他の製造所に出荷されるものを除く。)の保管を行う製造所ではない。つまり、市場への出荷を行う製造所ではない。
④【医薬品の場合】下記通知の2(2)イ~ニに該当する医薬品(生物学的製剤等)を取り扱う製造所ではない。
なお、上記①~④の条件のいずれか一つでも該当しない場合は、「登録」の対象とはならず、「許可」を取得する必要があります。
医薬品医療機器総合機構
化粧品製造販売業許可は5年ごとに更新します。化粧品製造業許可も同じです。
法第12条第4項の政令で定める期間は、5年とする。
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令 第3条
ただし、薬局製造販売医薬品の製造販売に係る許可については、同項の政令で定める期間は、6年とする。
その時の調査は、厚生労働大臣が独立行政法人医薬品医療機器総合機構に依頼しています。
化粧品は厚生労働省が監督しており、厚生労働大臣が機構に調査を行わせるときは、許可の更新の申請者は、機構が行う当該調査を受けなければなりません。
機構は、前項の調査を行つたときは、遅滞なく、当該調査の結果を厚生労働省令で定めるところにより厚生労働大臣に通知しなければなりません。
厚生労働大臣は、独立行政法人医薬品医療機器総合機構に、医薬品、医薬部外品又は化粧品のうち政令で定めるものに係る前条第1項若しくは第8項の許可又は同条第4項の許可の更新についての同条第7項に規定する調査を行わせることができる。
薬機法 第13条の2
独立行政法人医薬品医療機器総合機構(PMDA;Pharmaceuticals and Medical Devices Agency)は2004年4月1日に設立され、医薬品や医療機器などの品質、有効性および安全性について、治験前から承認までを一貫した体制で指導・審査し(承認審査)、国民保健の向上に貢献することを目的としています。
参照:医薬品医療機器総合機構

化粧品製造販売業許可 申請手続き方法
業者コード登録
許可(登録)申請する事務所又は製造所の所在地や業種が決まりましたら、e-Gov 電子申請サービス(やむをえない場合はファクシミリ)で厚生労働省へ業者コード登録票を提出して、コード番号の付番を受けてください。(注・このコード番号は許可番号ではありません。)
※業者コード登録票の提出先が、都道府県から厚生労働省へ変更されました。
化粧品製造販売業許可 申請
基本は、e-Gov電子申請サービスによる申請となります。
e-Gov電子申請サービスからの申請
① e-Gov電子申請サービス手続き検索にアクセス
② 「手続き名称から探す」に「業者コード」と入力して検索
③ 「医薬品医療機器等業者コード登録/変更登録」の「申請書入力へ」を選択
④ 必要事項を入力して提出
業者コード登録は、原則として上記e-Gov電子申請サービスからご申請ください。
やむをえず電子申請が行えない場合は、申請様式に必要事項を入力し、厚生労働省にファクシミリでご申請ください。
化粧品製造販売業許可 申請書作成
FD申請の場合の申請書作成概略は以下の通りです。
「医薬品等電子申請ソフト」は、厚生労働省が無償ソフトウェアとして配布しているものです。使用上の注意事項・Q&A・使用許諾契約書等をご確認のうえご利用ください。
(1)厚生労働省が提供する、「医薬品等電子申請ソフト(FD申請ソフト)」のダウンロード
(2)コンピューターへのインストール
(3)データベースメンテナンス−申請者情報登録(申請者と製造所等の業者コードについてそれぞれ行う。)
(4)申請用データの入力
(5)提出用データ等の作成(正本と申請者控の2部作成の場合)
申請書以外の添付書類は、両業種とも以下にご紹介します。

化粧品製造販売業許可 新規許可申請の添付書類
化粧品製造販売業許可 添付書類
総括製造販売責任者や、品質管理や製造管理に関する書類が中心になります。
1 登記事項証明書:法人の場合 発行後6か月以内のもの
2 薬事に関する業務に責任を有する役員(責任役員)の診断書
3 当該製造販売業の許可証の写し:申請者が現に製造販売業の許可を受けている場合
4 組織図:法人の場合のみ
5 総括製造販売責任者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
6 総括製造販売責任者の資格を証する書類
7 品質管理に係る体制に関する書類(GQP体制図)
8 製造販売後安全管理に係る体制に関する書類(GVP体制図)
9 配置図:同一敷地又は建物における、自社と他社使用部分を明示したもの
10 事務所の平面図:製造販売業として使用するフロアの図面。参考として、総括製造販売責任者の座席を明示。
11 保管設備に関する図面:市場への出荷可否判定のために、製造販売業者の事務所内で製品を保管する場合(市場への出荷可否判定を製造業者に委託しない場合)
12 事務所の案内図:最寄りの駅から事務所までの地図を添付

化粧品製造販売業許可 添付省略できる書類
次の書類については、都知事あてに他の申請書・届出に添付し、提出済みの場合は添付を省略することができます。
これは、二種類を同時に許可申請する時に片方だけでいい場合が該当します。
①登記事項証明書
②責任役員の診断書
③総括製造販売責任者の資格を証する書類
④総括製造販売責任者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
※内容が提出時と異なっている場合は添付の省略をすることができません。
化粧品製造業の添付書類
責任技術者や、製造施設や設備に関するものになります。
1 登記事項証明書:法人の場合 発行後6か月以内のもの
2 責任技術者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
3 責任技術者の資格を証する書類
4 構造設備の概要一覧表
5 製造設備器具一覧表
6 試験検査器具一覧表
7 他の試験検査機関等の利用概要及び契約書の写し又は利用証明書
8 製造所の配置図:同一敷地内の建物及び建物内の自社と他社の使用部分を示したもの
9 製造所の平面図:保管場所として棚を利用する場合は、その立面図も添付
10 製造しようとする品目の一覧表及び代表一品目の製造工程に関する書類
11 製造所の案内図:最寄りの駅から製造所までの地図を添付
製造業で添付省略できる書類
製造販売業も同時に申請する場合などで提出済みの場合は添付を省略することができます。
①登記事項証明書
②責任技術者の資格を証する書類
③責任技術者の雇用契約書の写し又は雇用若しくは使用関係を証する書類
更新は5年毎にあります
化粧品製造販売業および製造業ともに許可、登録は5年ごとに更新します。費用や標準処理期間は以下の通りです。後の記事で更新について詳細にお伝えいたします。
化粧品製造販売業許可 手数料
許可証と登録証ともに、製造販売業・製造業のどちらでも書換交付は2400円、再交付は3,400円になります。
| 化粧品 | 製造販売業 | 製造業 一般 | 製造業 包装等 | 製造業 登録-保管のみ |
| 新規 | 57,400円 | 39,000 | 32,800 | 29,600 |
| 更新 | 46,100 | 25,600 | 23,600 | 20,500 |

化粧品製造販売業許可 標準処理期間
製造業の区分変更で、許可区分を登録であった「保管」のみから、「包装・表示・保管」のような複数にする場合には、新規と同じく35日がかかります。
標準処理期間とは、窓口の処理に通常要する期間です。不備の訂正等に要した時間は含みません。また、標準処理期間の日数は開庁日で計算しますので、土曜日、日曜日及び祝祭日は含みません。
| 化粧品 | 製造販売業 | 製造業 許可 | 製造業 登録 |
| 許可、登録 | 35日 | 35 | 20 |
| 更新 | 20 | 20 | 15 |
| 書換え交付 | 10 | 10 | 10 |
| 再交付 | 10 | 10 | 10 |
| 区分変更又は追加許可 | - | 35 | - |
参照:標準処理期間について
化粧品製造販売業許可 新規申請は行政書士にご依頼ください
化粧品製造販売業許可 新規申請は行政書士にご依頼ください
以前には薬事法として薬中心でまとめられていましたが、薬機法は正式名称を「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」と言うように、医療機器や安全性なども吸収して大きく管理する仕組みとなりました。医薬品等は人の生命や健康に直接関わるものです。そのため、薬機法では医薬品等の品質不良や虚偽・誇大広告などによる、国民の健康被害を防ぐことを目的に、製造や販売、製品の表示・広告に至るまで厳しい規制が設けられています。
今回の化粧品においても、似たような性質を持つ医薬品、医薬部外品、化粧品、医療機器、再生医療等製品の5業種がおおよそ同じ体系で管理されています。その手続きを新規と、業界情報なども取り込んだ更新に分けながらお伝えしたいと思っています。
昨今の薬機法改正などで規制緩和が進み、医薬業界も行政手続きをすればビジネスを拡大していける可能性が広がりました。皆様の起業や事業拡大の要望を実現に向けてお手伝いいたします。

化粧品製造業および 製造販売業の許可申請は、薬剤師などの総括製造販売責任者の確保さえできれば困難ではないと言われています。製造設備器具及び試験検査設備器具一覧や、付近の見取り図、平面図及び建物の配置図なども作成も含めて、行政書士にご依頼いただけば、申請書類の準備等のお手伝いをいたします。
化粧品業の宿命として、商品が人体に直接影響を与えます。ですから、製造販売業者は製品の品質や安全性などに責任を持たなければなりません。そのため、製造所の国内国外を問わず、品質管理や製品の試験検査など、自社の化粧品が適正かつ安全に製造されていることを確認し、必要に応じて改善指示を行う必要があります。
そのために、許可申請でも業者の事務管理能力等も審査する場合がありますので、行政手続きに熟練した行政書士を活用すれば順調に運ぶことになるでしょう。化粧品製造業の認可を受けた後、化粧品を製造する上で様々な書類が必要になります。
法律の専門家である行政書士は、化粧品業の許可申請だけにとどまらず、5年ごとの更新や、その間の法律的な変更への対応など、継続的なお手伝いをさせていただきます。さらに要件や審査が厳しいが収益が高いと言われる医薬部外品製造業許可の取得など、隣接した業界への進出などもアドバイス可能です。
医薬業界は、薬機法で統括されています。薬機法は医薬品等の品質や有効性、安全性を確保し、保健衛生の向上を目的とした法律です。
申請ALL. com での 化粧品製造販売業許可 見積もりの探し方
当サイト 申請ALL.com は登録不要で行政書士見積もりを自動でお示しする便利なサイトです。
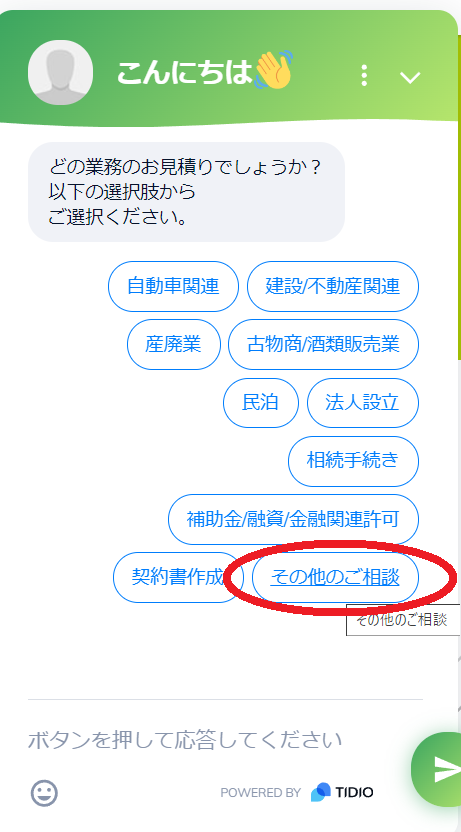
- 画面右下のチャットボットを開く
- 業務分類から”その他のご相談”をクリック
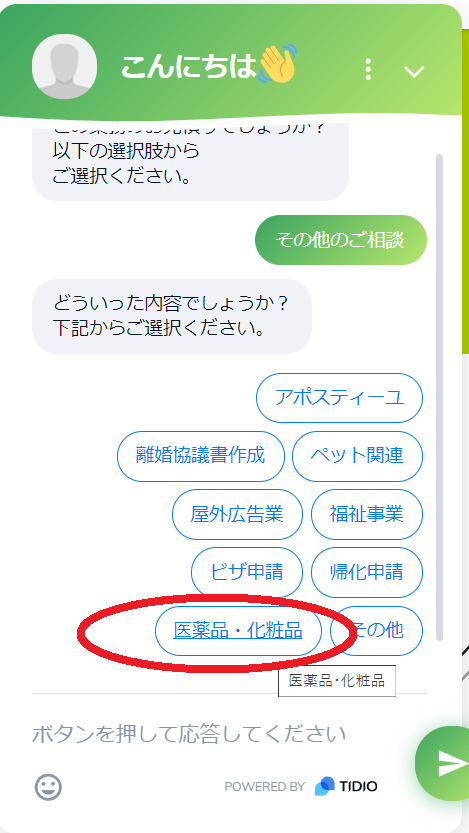
- その他の業務の中から”医薬品・化粧品”をクリック
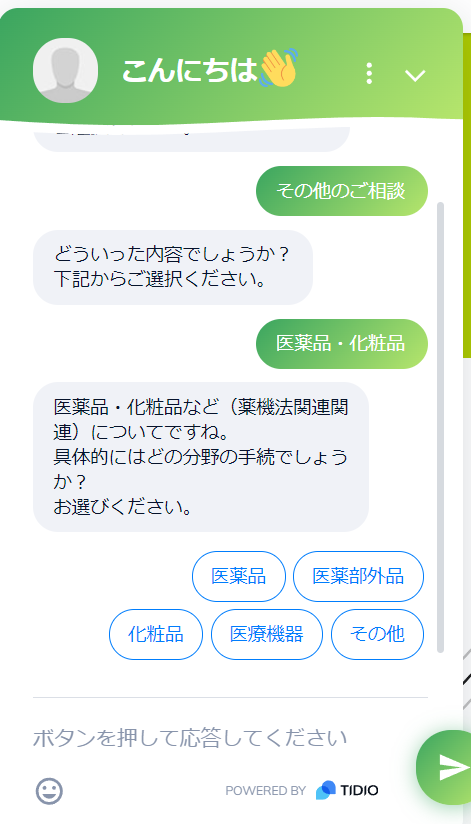
- 医薬品・化粧品(薬機法関連)の中から対象分野を選択
- その後必要事項を選択し、簡単な質問に答えるだけで、自動でお見積もりが表示されます。
チャットを途中で離脱した場合など、過去の「キャッシュ」が残っていると、スタート画面に戻れない場合があります。
一度、キャッシュを削除して、最初からチャットをスタートしてください。
過去のキャッシュを削除する方法は『申請ALL.comの キャッシュを削除するには?』をご覧ください

開業支援も行政書士にご依頼ください
開業を控えたお客様もご活用ください。
当サイト 申請ALL.com は全ての行政手続にワンストップ対応します。
化粧品製造販売業許可のみならず、会社設立や資金調達、契約書等の書類の作成なども行います。
参考記事:会社設立 ~ 株式会社設立

